dr. sc. Marija Abramić
Kristalna struktura otkriva fleksibilnost molekule ljudskog proteina
Hrvatska znanstvenica s Ruđera koautor je znanstvenog rada o reguliranju boli u sisavaca.
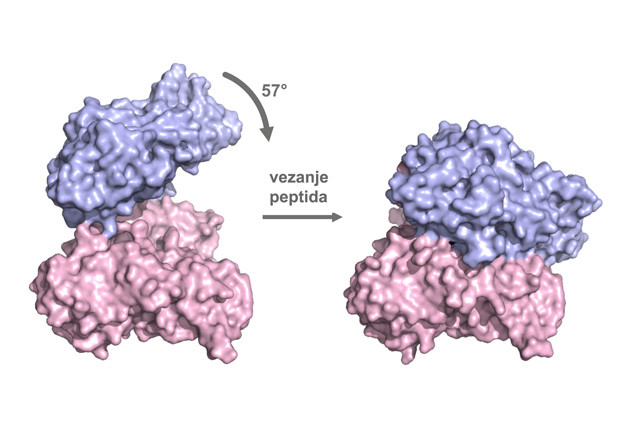
Prikaz fleksibilnosti ljudske dipeptidil-peptidaze III. Lijevo je slobodni protein (otvorena forma), prije interakcije sa peptidnim supstratom; desno kompleks DPP III-supstrat (zatvorena forma). Vezanje peptida uzrokuje veliko pomicanje dviju domena (označene plavo i ružičasto) proteina i potpuno zatvaranje aktivnog mjesta enzima.
Znanstvenica Instituta Ruđer Bošković dr. sc. Marija Abramić, voditeljica Laboratorija za celularnu biokemiju, koautor je znanstvenog rada "Entropy-driven binding of opioid peptides induces a large domain motion in human dipeptidyl peptidase III" koji daje važan doprinos razumijevanju interakcije proteina i peptida te povezanosti između fleksibilnosti i funkcije proteinskih makromolekula.
Rad međunarodnog tima znanstvenika, objavljen u prestižnom časopisu Proceedings of the National Academy of Sciences of the United States of America, rezultirao je rješavanjem kristalne strukture ljudskog enzima dipeptidil-peptidaze III (DPP III) u interakciji s njegovim supstratom, opioidnim peptidom tinorfinom. Razjašnjenje načina na koji ova peptidaza veže svoje supstrate otkriva izuzetno veliku fleksibilnost ove molekule i njenu povezanost s katalitičkom ulogom ovog enzima.
DPP III je prisutna u svim tkivima sisavaca te je pronađena u genomima velikog broja nižih organizama i kod nekih bakterija. Pored uloge u unutarstaničnoj razgradnji proteina, indicirana je uloga DPP III u vrlo složenom fiziološkom procesu regulacije osjeta boli. Na to ukazuje prisutnost tog enzima u području leđne moždine u kojem se nalaze i opioidni peptidi (enkefalini i endomorfini), čiju hidrolizu DPP III vrlo efikasno katalizira.
Pored fizioloških, za DPP III su pretpostavljene i patofiziološke uloge u nastanku očne mrene (katarakte) i tumorskom rastu. Rezultati istraživanja također su značajni i s biomedicinskog gledišta jer otvaraju mogućnost dizajniranja specifičnih inhibitora ove peptidaze obzirom na pretpostavljenu fiziološku ulogu u reguliranju boli u sisavaca.
Znanstveni rad je rezultat interdisciplinarne suradnje istraživača iz Instituta za molekularne bioznanosti (Austrija), Instituta za biokemiju (Austrija), Konzorcija za strukturnu genomiku Sveučilišta u Torontu (Kanada) te Instituta Ruđer Bošković. Suradnja se većim dijelom odvijala u okviru hrvatsko-austrijskog bilateralnog projekta "Odnos strukture i funkcije metalopeptidaza porodice M49" temeljenog na višegodišnjim istraživanjima provedenim na Ruđeru.
Dr. sc. Marija Abramić znanstveni je savjetnik na Institutu Ruđer Bošković s dugogodišnjim iskustvom istraživanja u području biokemije hidrolitičkih enzima, peptidaza i lipaza, njihove izolacije iz prirodnih izvora i fizikalno-kemijske karakterizacije.
Sadašnji znanstveni interes dr. Abramić usmjeren je na molekularnu enzimologiju metalopeptidaza – odnos strukture i aktivnosti, mehanizam katalize i proteinske interakcije. Od 2002. godine dr. Abramić je voditelj Laboratorija za celularnu biokemiju u koji uvodi metode molekularne biologije i bioinformatike, a rad fokusira na molekularnu analizu proteina iz porodice dipeptidil-peptidaza III (porodica DPP III, porodica metalopeptidaza M49).
Dr. Abramić je ekspert u području istraživanja ove grupe metalopeptidaza, problematike koju je razvijala na IRB-u uspostavljajući unutar-institucijsku i međunarodnu suradnju te obrazujući mlade istraživače. Dosad je objavila ukupno 47 znanstvenih publikacija, a radovi su joj citirani oko 550 puta. Pod njenim vodstvom izrađena su dva doktorata, tri diplomska i jedan magistarski rad iz područja metalopeptidaza.
Laboratorij za celularnu biokemiju (LCB) Instituta Ruđer Bošković ima dugu tradiciju istraživanja u području biokemije proteolitičkih enzima. LCB je razvio višegodišnju uspješnu suradnju s članovima drugih laboratorija Instituta Ruđer Bošković (8 laboratorija, iz 4 zavoda), sa Sveučilištem Josip Juraj Strossmayer u Osijeku te, kroz bilateralne projekte, sa znanstvenicima iz Graza.
Članovi LCB-a u periodu od 2000. godine do danas objavili su 35 publikacija u renomiranim časopisima. Rad The first structure of dipeptidyl-peptidase III provides insight into the catalytic mechanism and mode of substrate binding, objavljen 2008. godine zajedno sa suradnicima iz Austrije u The Journal of Biological Chemistry, predstavljao je znanstveni prodor i bio uvršten u vrhunske ("top 1%", Paper of the Week) zbog razjašnjenja strukture prototipa za novu porodicu proteina.
Izvor: irb.hr














Učitavam komentare ...